- Design of an Actuator Using Electro-active Polymer (EAP) Actuator with Composite Electrodes
Dong-Uk Kim*, Seung-Hwan Chang*†
* School of Mechanical Engineering, Chung-Ang University
*† School of Mechanical Engineering, Chung-Ang University- 복합재료 전극을 가진 전기활성고분자 구동기의 설계
김동욱* · 장승환*†
The cell culture process under in vitro
condition is much different from the actual human body environment. Therefore,
in order to precisely simulate the human body environment, a dynamic cell
culture device capable of delivering mechanical stimulation to cells is
essential. However, conventional dynamic cell culture devices require
relatively complicated devices such as tubes, pumps, and motors, and the
mechanical stimuli delivered is also simple. In this study, an electro-active
polymer actuator as a driving component is introduced to design simply driven
dynamic cell culture device without complicated components. The device is
capable of delivering relatively complex mechanical stimuli to the cells.
정적인 상태인 체외 환경(in vitro)에서의 세포배양 과정은 실제 생체 내 환경에서의 세포발달과정과는 많은 차이가 존재한다. 따라서, 체내 환경의 정밀한 모사를 위해서는, 기계적인 자극을 세포에 전달하여 줄 수 있는 동적 세포배양장치가 필수적이다. 하지만 기존의 동적 세포배양장치에는 튜브, 펌프, 모터 등의 비교적 복잡한 장치들을 필요로 하였으며, 전달되는 기계적 자극도 단순한 형태였다. 본 연구에서는 단순한 장치로 구동되는 동적 세포배양장치를 위하여 전기활성고분자(EAP) 구동기를 동력원으로 하는 소형 동적 세포배양장치를 설계하였다. 이 장치는 다양한 기계적 자극을 세포에 전달하는 것이 가능하다.
Keywords: 유전 탄성체(Dielectric elastomer), 세포배양장치(Cell culture device), PDMS(Polydimethylsiloxane), 복합재료 전극(Composite electrodes)
동적인 환경에서의 세포배양이 세포에 긍정적인 영향을 가져온다는 연구 결과가 보고되고 있으며[1,2], 이러한 보고에 따라
세포에 물리적 자극을 전달하기 위한 여러 연구가 시도되고 있다[3-6]. 그러나 이러한 동적 세포배양장치들은 체외 환경에서도 동적인 체내 환경을 모사하기 위하여,
대게 유체의 압력이나 흐름 등을 동력으로 사용하기 때문에 일반적으로 독립된 별개의 대형 동력원을 필요로 한다. 세포배양을 위해서는 인큐베이터 내
배양이 필수적이나, 이러한 동력원들은 협소한 인큐베이터 내의 공간을 크게 차지할 뿐 만 아니라, 배양하는 세포들에 오염을 발생시키기 쉬운 환경을
형성하게 된다.
유전 탄성체(Dielectric elastomer) 구동기(Actuator)는 소형화가 가능하고, 근육과 유사한 움직임을 보이며, 인가되는
전압에 대응하여 다양한 기계적 거동의 구현이 가능하며, 반응속도가 비교적 빠른 장점이 있다[7-9]. 유전 탄성체중 하나인 PDMS(Polydimethyl siloxane)는 세포 독성이 없는
생체적합성 고분자로, 탄성을 가지며 몰드의 형상에 따라 경화하여 임의의 형상 제작이 용이하며, 절연성능이 뛰어나기 때문에 많은 연구에 유용하게
활용되고 있다[10,11].
본 연구에서는 EAP와 PDMS의 장점을 활용하여 기계적 자극의 전달이 가능한 동적 세포배양장치를 설계하였다. 세포배양장치의 구동을
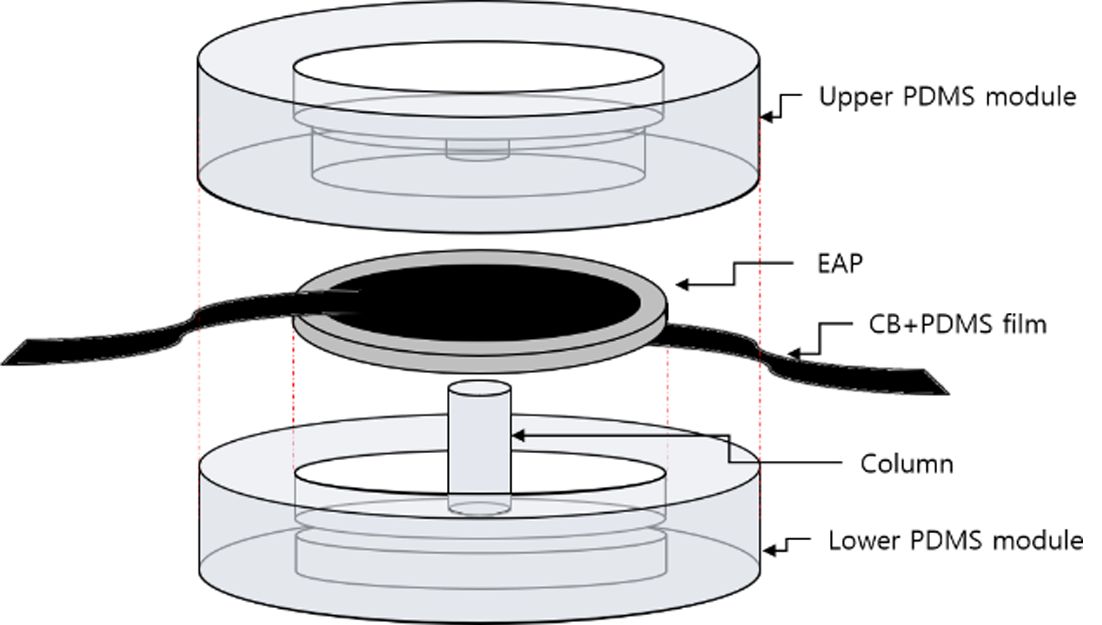
극대화 하기 위해 유연한 전극이 필요하며, 이를 위해 탄소분말이 함유된 유연 전극을 적용하였다. 상/하부로 구성된 PDMS 모듈(Module)은
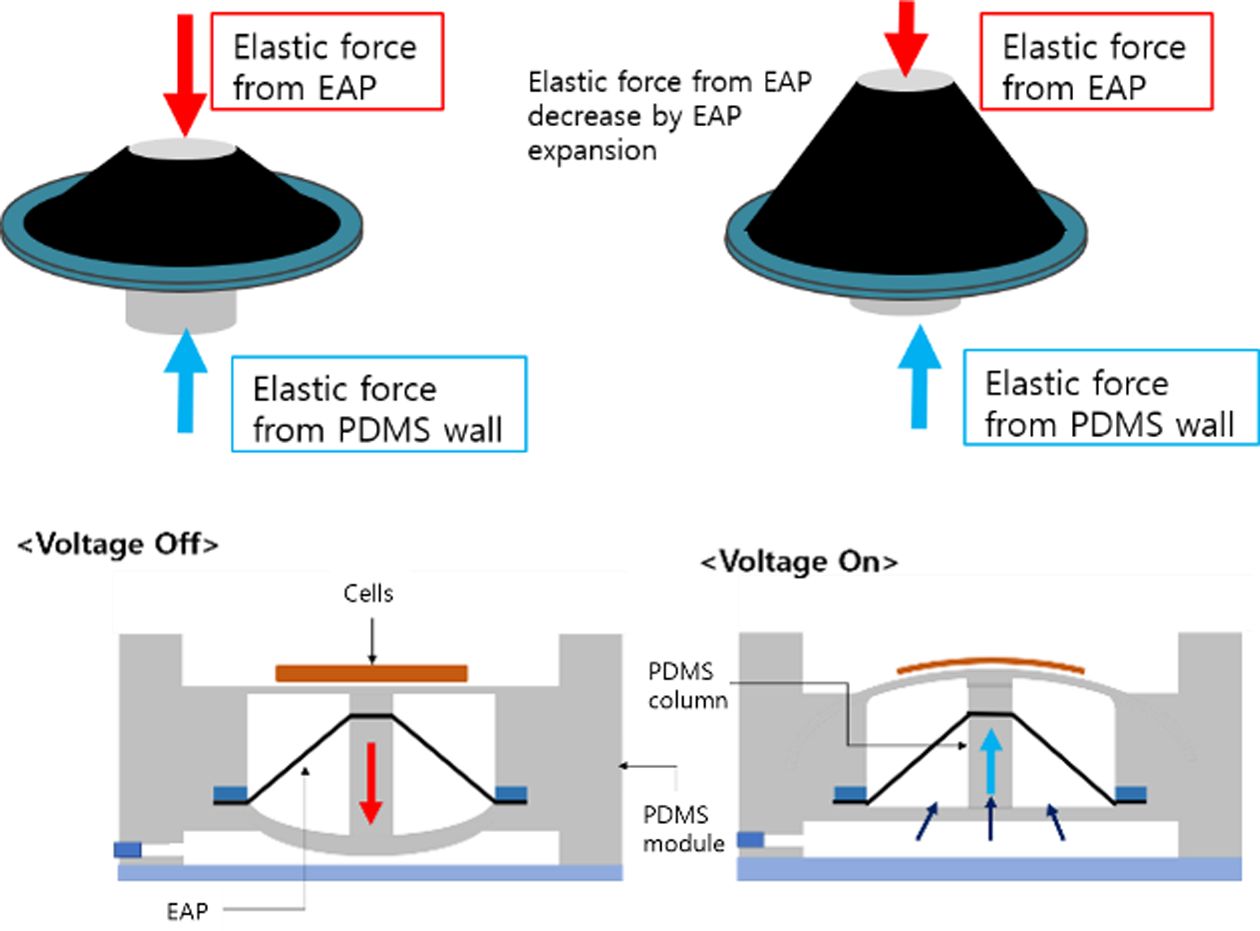
EAP의 전극과 세포 간의 접촉을 방지하며, 상/하부의 PDMS 모듈 (Module) 사이에 삽입되는 EAP 구동기는 중앙의 PDMS 기둥(Column)을
상하로 움직여줌으로써 상부 PDMS 모듈에 형성된 배양부에 기계적 자극을 전달하게 된다.
2.1 PDMS 모듈
(Module)
PDMS 모듈은 상부와 하부로 구성되며, 상부에는 세포를 배양할 수 있는 배양부가 있으며, 하부는 배양장치의 구동부인 전기활성고분자
박막과 연결되는 PDMS 기둥(Column)이 존재하며, 전기활성고분자 박막을 고정할 수 있게 되어 있다.
PDMS 모듈의 금형 패턴 제작을 위하여 3D 프린터를 사용하였으며, 패턴의 소재는 열변형이 적은 PLA (Polylactic
Acid)를 사용하였다. 상/하부 성형을 위한 액상 PDMS 용기로는 지름 55 mm인 페트리 디쉬를 사용하여
구조물의 외부 치수를 기존 세포배양장치와 유사하게 설계하였다.
PDMS와 경화제는 10:1의 질량비로 섞었으며, 혼합상태에서 1차로 진공 감압하여 기포를 제거하여 사용하였다. 먼저 페트리 디쉬에
하부패턴을 접착하였고, 1차 기포제거가 끝난 PDMS 혼합액을 부은 후, 윗부분 패턴을 덮고, 다시 진공 감압하여 2차 기포제거를 시행하였다.
2차 기포제거가 끝난 후, PLA 패턴의 위치를 점검하고 다시 한번 3차 기포제거를 진행하였다. 이때 2차 기포제거 과정에서 PDMS가 PLA
패턴 내부의 빈공간으로 침투하여 경화 후에 기포가 발생하지 않게 해준다. 마지막 3차 기포제거가 끝난 후 55oC에서 30분간 1차적으로
경화시키고, 하부 PDMS 모듈의 PDMS 기둥 제작을 위하여 PDMS 혼합액을 상부 패턴 위에 붓고 다시 30분간 경화시켰다.
2.2 EAP actuator
전기활성고분자 구동기의 소재는 아크릴계열 탄성 중합체(VHB 4910, 3M, USA)를 사용하였으며, 사전 인장(Pre-stretching)은
600%를 가해주었다. 사전 인장된 유전 탄성체를 고정하기 위하여 외경 30 mm, 내경 25 mm, 두께 3.6 mm의 PC로 제작된 원형
고정틀을 사용하였다. 전기활성고분자의 전극으로는 전도성 카본 구리스를 얇게 도포하였으며, 전원장치와 전극의 연결에는 유연 복합재료 전극인 전도성
PDMS 필름을 제작하여 사용하였다.
Fig. 1 Fig. 2 Fig. 3
2.3 유연 복합재료 전극
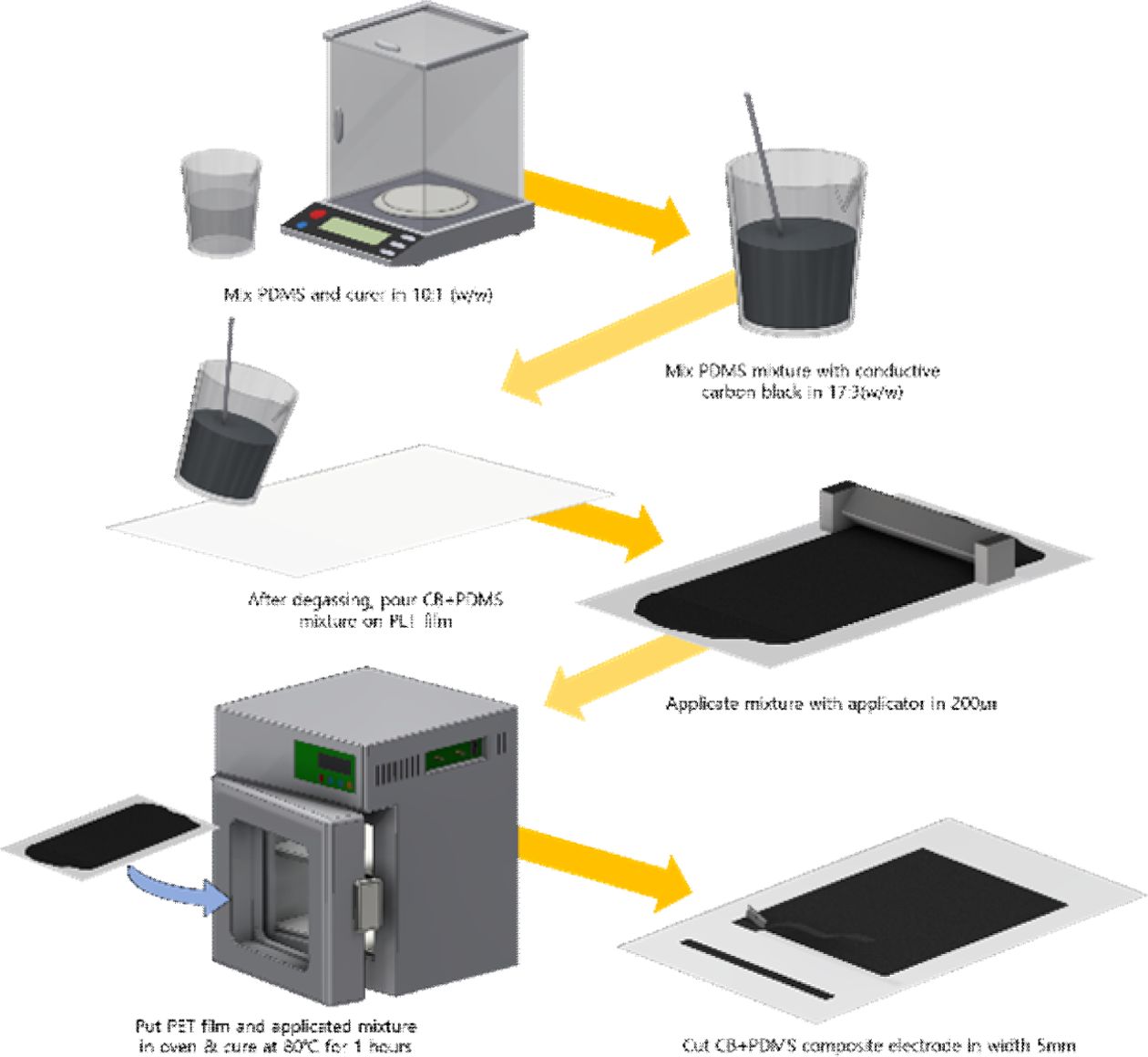
전도성 PDMS 필름을 제조하기 위해 PDMS 경화제를 10:1 질량비로 섞은 뒤, 전도성 카본 블랙 분말을 PDMS 용액과
17:3 질량비로 섞은 후, 1시간동안 진공 감압하여 기포를 제거하였다. PET 필름 위에 어플리케이터를 사용하여 200 mm 로 균일하게 도포하였고, 80oC에서 1시간동안 경화시켜
제작하였다. 위의 EAP 연결에 사용하기 위하여 제작한 전도성 PDMS 필름을 폭 5 mm로 잘라 사용하였다(Fig. 4 참조).
필름 형태를 갖는 유연 복합재료 전극은 전기활성고분자 양단의 전극에 전압을 인가해 주기에 매우 적합한 조건을 갖고 있다. 금속성 전선이나
구리테이프와 같은 소재는 전기활성고분자 구동기의 반복적인 구동 중에 전기활성고분자 필름에 손상을 주어 전기적 파괴를 일으키는 경우가 많다. 하지만,
유연성 복합재료 전극의 경우, PDMS로 제작되어, 전기활성고분자 필름에 손상을 발생시키지 않으며 전압 인가가 가능한 장점이 있다.
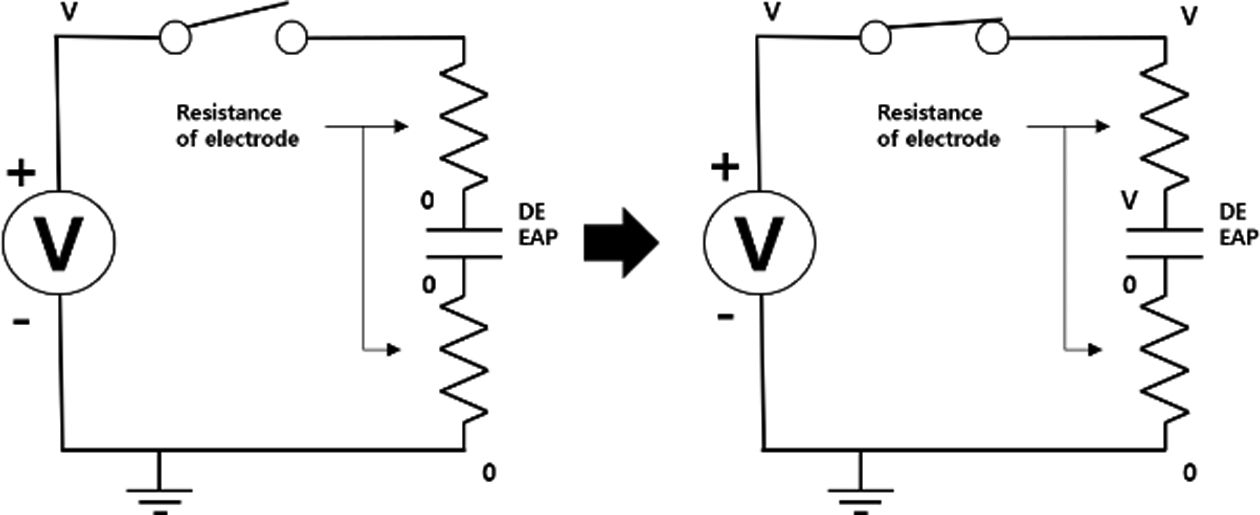
전기활성고분자 구동기의 전압을 인가받는 구조를 간단한 등가 회로로 표현하면, Fig. 5와 같은 형태로 나타낼 수 있다. 유전성 탄성체 전기활성고분자(DE EAP)는 유전성 탄성체를
유전체로 갖는 커패시터와 같으므로, 전압이 인가될 경우 양단의 전극에 전하가 충전되며 그림과 같은 전압상태를 갖게 된다. 즉, 전류가 전기활성고분자
구동기를 통과하여 흐르지 않고 양 전극부에 충전되고, 그 전압 차로 인하여 전기활성고분자가 구동하는 것이므로, 전극의 저항은 전기활성고분자에 전하가
충전되는 속도에 미세한 영향을 주긴 하여도, 변형량에는 영향을 끼치지 않는다.

|
Fig. 1 Module structure made of PDMS; (a) Molds for module forming, (b) Fabricated upper and lower modules |
|
Fig. 2 Working principle of the actuator; (a) voltage off phase, (b) voltage on phase |
|
Fig. 3 Assembly of the upper and the lower modules with the EAP actuator |
|
Fig. 4 Fabricating process of flexible composite electrodes |
|
Fig. 5 Equivalent circuit of EAP |
3.1 실험 구성
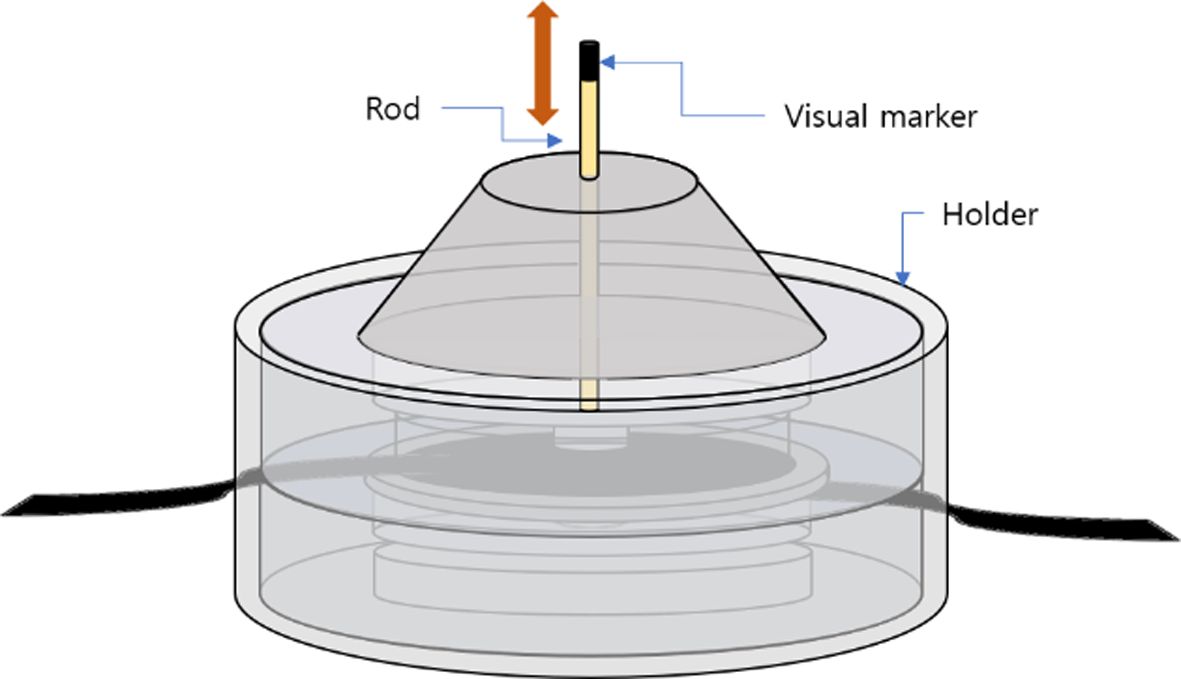
세포배양 구동부의 정확한 수직방향 거동을 정확하게 측정하기 위하여 구동부에 Fig. 6과 같이 시각적 마커 (Visual marker)를 붙여서 구동부에 발생하는 변위를 측정하였다. Fig. 7
입력 전압의 2000배 승압이 가능한 증폭기(Amplifier)를 함수발생기(Function generator)에 연결하여, 사인파의 진폭이 0~4.8 kV(피크 0~±2.4 kV)인 AC전압을 0.5, 1.0, 1.5, 2.0 Hz의 조건으로 전기활성고분자 구동부에 인가하였다. 또한 0~2.4 kV의 DC 전압을 인가하는 실험을 진행하여 AC전압과의 차이를 비교하였다.
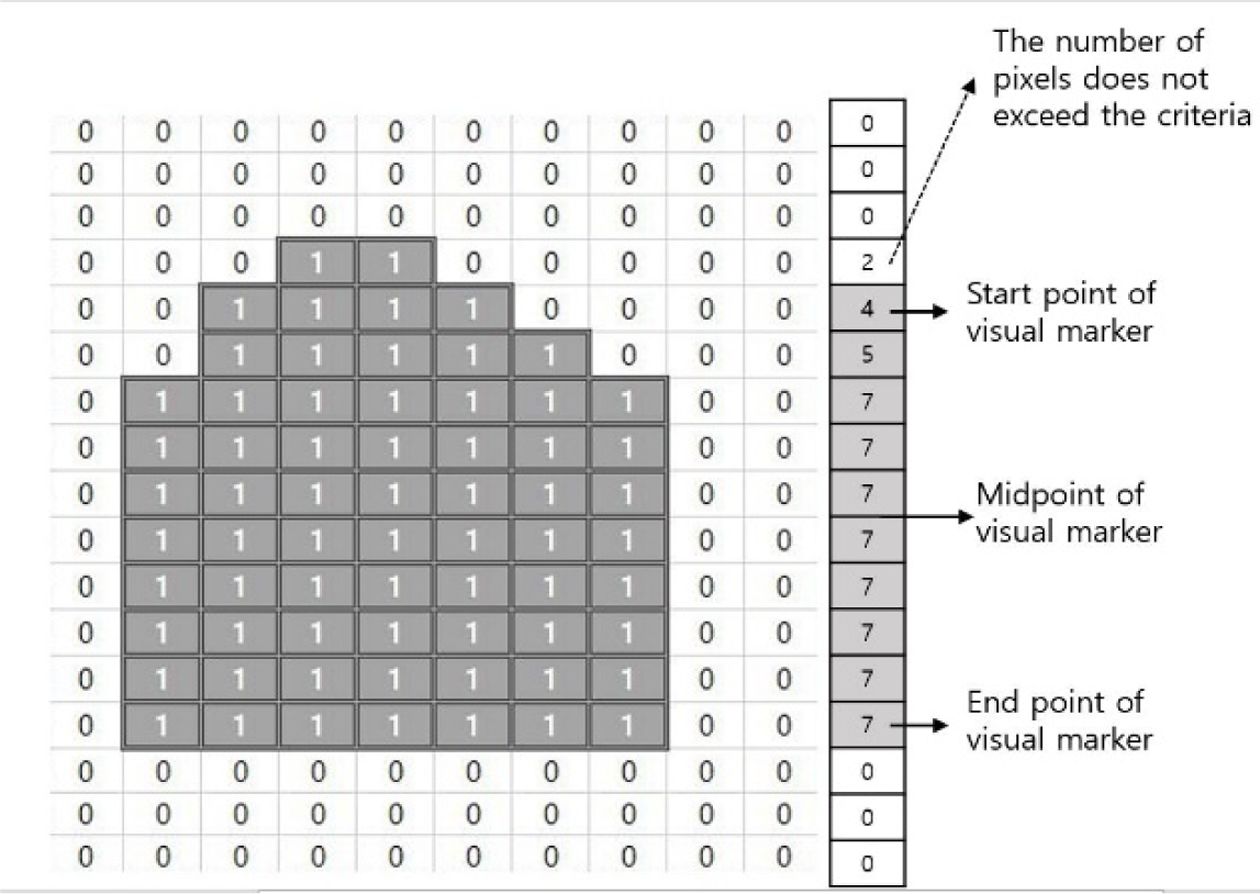
촬영한 영상은 MATLAB의 영상처리 기능을 사용하여 데이터화 하였다. 연산의 고속화를 위하여, 촬영된 트루컬러 이미지를 각 픽셀당 0~255 사이의 값을 갖는 회색조 명암 이미지로 변환하였다. 또한, 배경으로 생기는 노이즈를 제거하기 위하여, 시각적 마커가 움직이는 범위만을 기록할 수 있도록 다각형 관심 영역 지정(ROI) 함수를 이용하여 이진 영상 마스크를 적용하였다. 이진 마스크가 적용된 명암 이미지의 각 픽셀 중 30 미만의 값을 갖는 픽셀들은 1로, 30 이상의 값을 갖는 픽셀들은 0으로 변환시켜 이미지를 전체적으로 이진화 시킨 후, Y축으로 히스토그램화 하였다. Y축 히스토그램 값에서 4이상의 값을 갖는 처음과 끝의 Y축 위치를 구한 뒤 나누어, 시각적 마커의 중앙점 위치를 도출하였다. 도출된 마커의 위치 데이터는, 불러온 영상의 FPS(Frame per second)로부터 계산된 이미지 간의 시간차 데이터와 결합하여 Fig. 8과 같은 시간-위치 데이터로 기록하였다.
3.2 결과
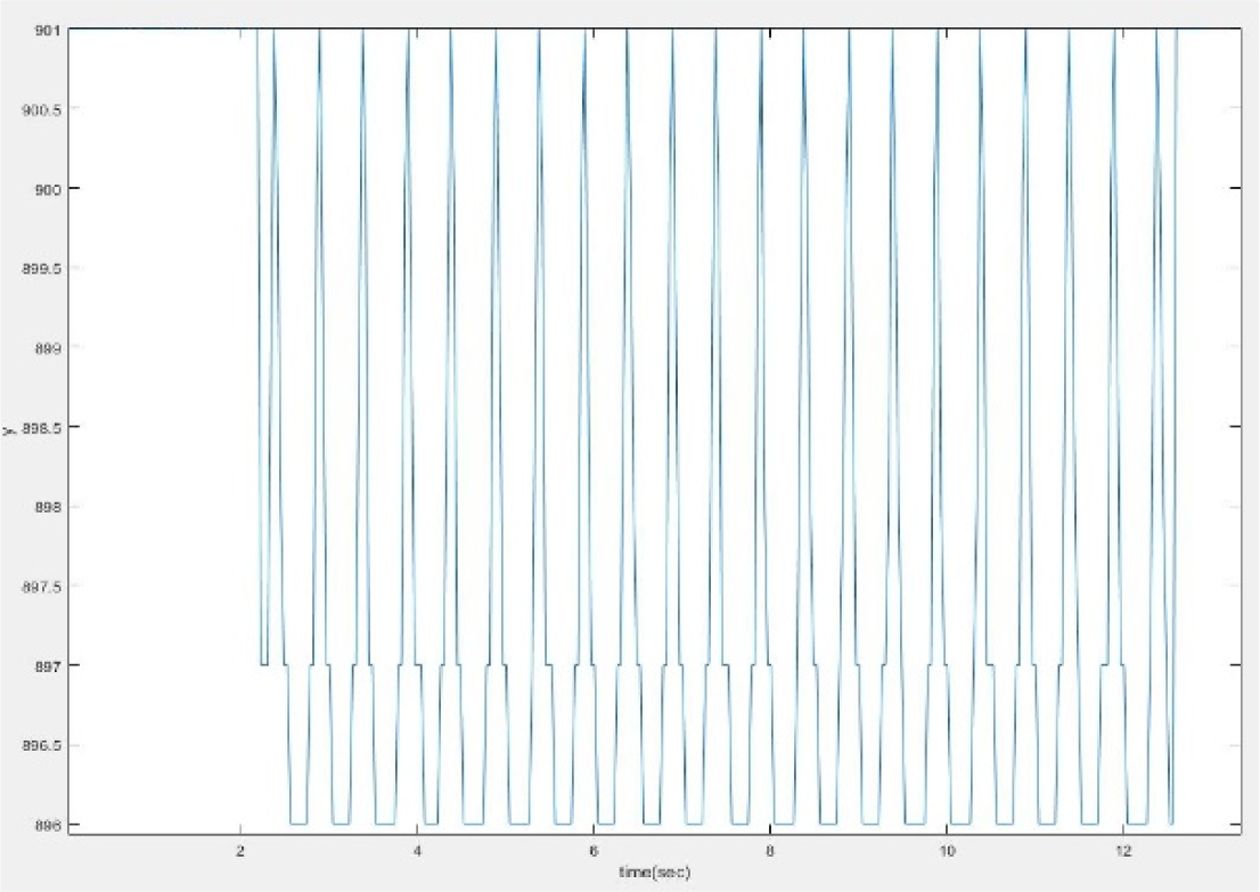
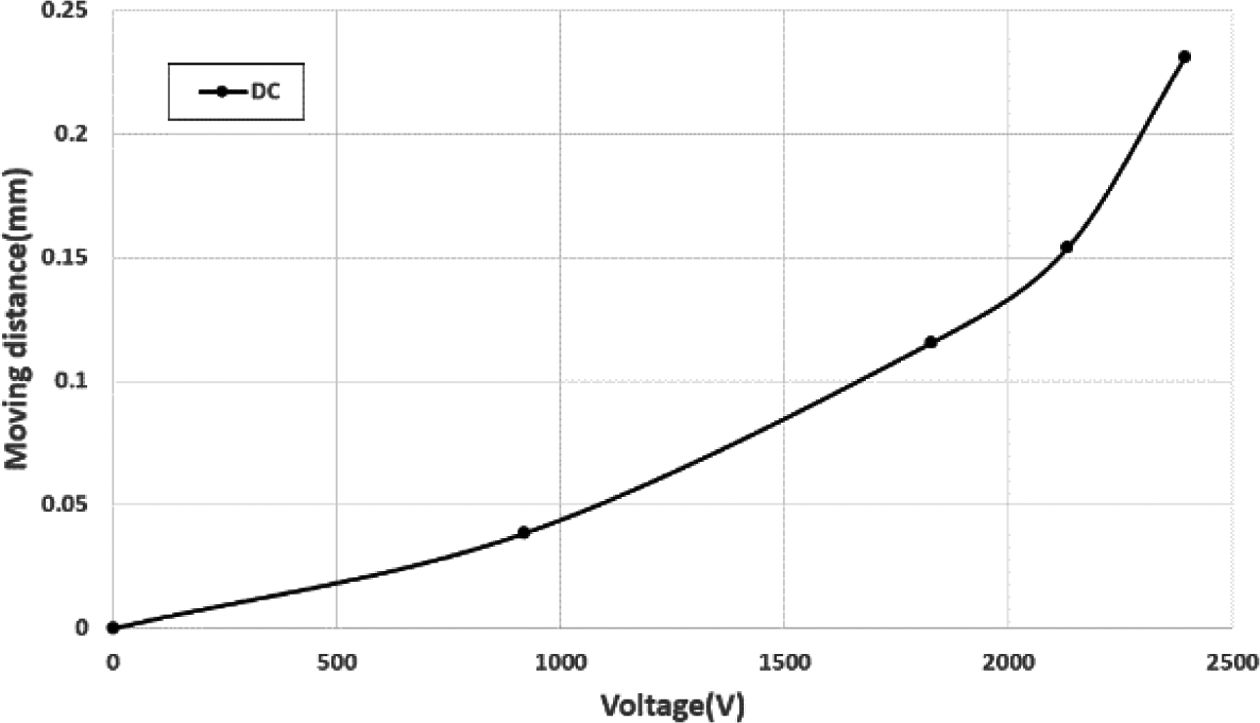
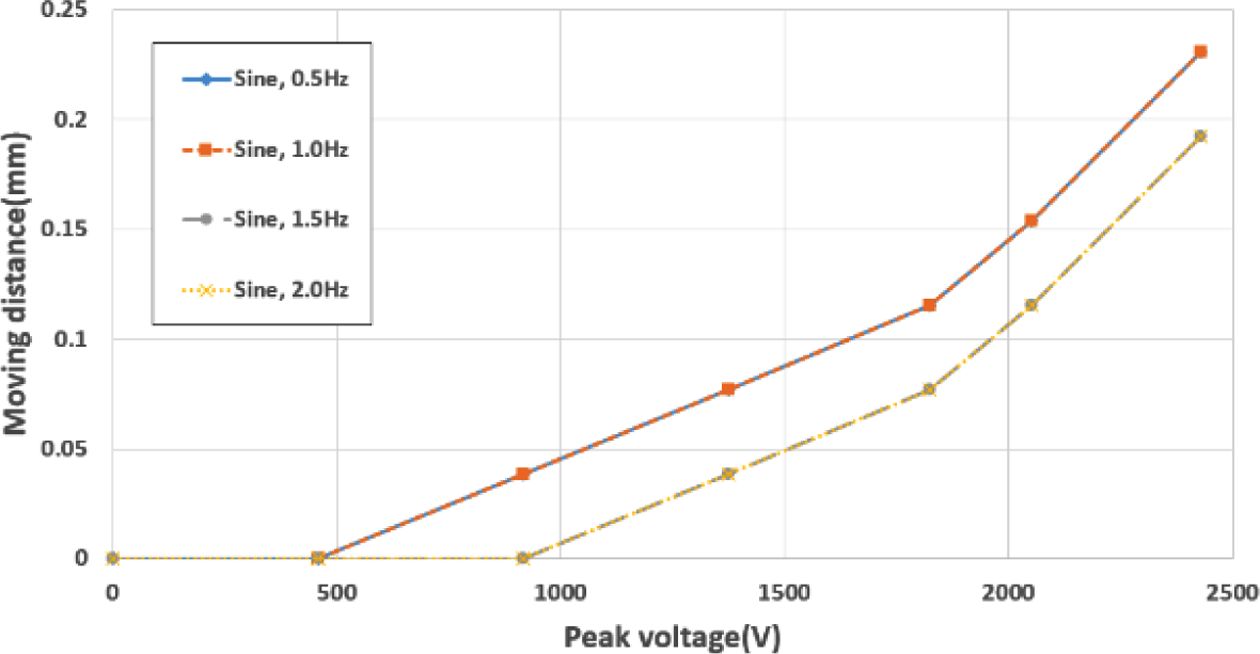
실험 장치에 부착된 자의 0.5 mm 눈금의 간격은 13 pixels이다. 최대 인가전압 2.4 kV를 부가 시, 0.2308 mm (6 pixels)의 변형이 생기는 것을 확인할 수 있다. 실험 결과, 배양부의 높이 변화는 Fig. 8의 그래프와 같은 형태로 나타났으며, 전압 인가에 따라 빠른 변형 속도와 규칙적인 변형을 갖는 것을 확인할 수 있다.
DC 전압 인가 시의 결과인 Fig. 9와 AC 전압 인가 시의 결과인 Fig. 10을 비교해 보면, 1.0 Hz의 거동까지는 DC 전압 인가 시의 변형량과 거의 동일하지만, 1.5 Hz부터는 1 pixels (=0.0385 mm)씩 전체적인 변형량이 감소하는 것을 확인 할 수 있다. 반면 모든 결과에서 주파수가 높아져도 변형량에만 차이가 있을 뿐, 변형 형태는 거의 비슷한 것으로 나타났다.
|
Fig. 6 A visual marker for checking vertical displacement of the actuator |
|
Fig. 7 Displacement measurement by using marker visualization technique |
|
Fig. 8 Displacement behavior under the condition of 1.0 Hz-2.4 kV sinusoidal power supply |
|
Fig. 9 Displacement under DC power supply |
|
Fig. 10 Displacement under sinusoidal AC power supply |
결과값에 따라 최대 변형인 0.2308 mm의 변형이 발생할 때,
세포배양 구동부의 지름인 29.5 mm의 값으로부터, 곡률 2.1212 × 10¯³(1/mm)를 구할 수 있다. 이는 일반적인 유연 구동기의 관점에서는
대변형이라 보기 어렵지만, 일반적인 고체의 변형량과 비교하면 매우 큰 값이며, 세포배양에 필요한 변형률을 고려할 때 충분한 값이라고 판단된다.
더불어,
구동기의 빠른 변형 속도와 인가 전압 형태에 따라 발생하는 정확한 변형량 및 구동기의 작은 크기는 본 연구를 통해 개발된 구동기의 주요 장점이다.
이번 실험 연구를 토대로, 보다 넓은 응용분야를 찾기위해 더 큰 변형량을 갖는 구동장치를 설계해야 할 필요성이 있다. 본 연구를 통해 구현된
구동장치의 성능을 더욱 향상시키기 위해서는 상부 PDMS 모듈의 PDMS 박막 (Membrane)으로 이루어진 배양부의
두께를 더욱 줄이고, EAP의 크기 및 하부 PDMS 모듈의 구조의 수정, 그리고 더 높은 수준의 인가 전압 등이 필요할 것으로 판단되며, 이러한
개선을 통해 더 높은 수준의 구동 변형률을 구현할 수 있을 것으로 기대된다. 또한, 더욱 정밀한 곡률의 측정을 위하여 변형 표면의 레이저 측정
등의 방법의 고려가 필요하다 보여진다.
본 연구에서는 국가연구개발사업(미세자극 조절이 가능한 정소 오가노이드 기반 융합 플랫폼 개발)의 지원을 받아 수행된 연구결과입니다.
- 1. Dhein, S., Schreiber, A., Steinbach, S., Apel, D., Salameh, A., Schlegel, F., Kostelka, M., Dohmen, P.M., and Mohr, F.W., “Mechanical Control of Cell Biology. Effects of Cyclic Mechanical Stretch on Cardiomyocyte Cellular Organization,” Progress in Biophysics & Molecular Biology, Vol. 115, 2014, pp. 93-102.
-

- 2. Kaspar, D., Seidl, W., Neidlinger-Wilke, C., Ignatius, A., and Claes, L., “Dynamic Cell Stretching Increases Human Osteoblast Proliferation and CICP Synthesis but Decreases Osteocalcin Synthesis and Alkaline Phosphatase Activity,” Journal of Biomechanics, Vol. 33, 2000, pp. 45-51.
-

- 3. Jung, K.C., Jeon, G.J., Bae, J.H., and Chang, S.H., “Flexible Cell Culture Device Made of Membrane-type Silicone Composites for Simulating Human Body,” Composite Structures, Vol. 134, 2015, pp. 36-43.
-

- 4. Dhein, S., Schreiber, A., Steinbach, S., Apel, D., Salameh, A., Schlegel, F., Kostelka, M., Dohmen, P.M., and Mohr, F.W., “Mechanical Control of Cell Biology. Effects of Cyclic Mechanical Stretch on Cardiomyocyte Cellular Organization,” Progress in Biophysics & Molecular Biology, Vol. 115, 2014, pp. 93-102.
-

- 5. Yung, Y.C., Vandenburgh, H., and Mooney, D.J., “Cellular Strain Assessment Tool (CSAT): Precision-controlled Cyclic Uniaxial Tensile Loading,” Journal of Biomechanics, Vol. 42, 2009, pp. 178-182.
-

- 6. Lam, M.T., Clem, W.C., and Takayama, S., “Reversible On-demand Cell Alignment Using Reconfigurable Microtopography,” Biomaterials, Vol. 29, No. 11, 2008, pp. 1705-1712.
-

- 7. Li, B., Lin, Z.J., Ryu, S.R., and Lee, D.J., “Effects of Thickness, Elastomer Types and Thinner Content on Actuation Performance of Electro Active Dielectric Elastomers,” Composites Research, Vol. 27, No. 1, 2014, pp. 25-30.
-

- 8. Brochu, P., and Pei, Q., “Advances in Dielectric Elastomers for Actuators and Artificial Muscles,” Macromolecular Rapid Communications, Vol. 31, No. 1, 2010, pp. 10-36.
-

- 9. Ariano, P., Accardo, D., Lombardi, M., Bocchini, S., Draghi, L., De Nardo, L., and Fino, P., “Polymeric Materials as Artificial Muscles: An Overview,” Journal of Applied Biomaterials & Functional Materialsd, Vol. 13, No. 1, 2015, pp. 1-9.
-

- 10. Han, S.H., and Hwang, H.Y., “Fabrication of Microstructures with Nanocomposites by Capillary Effect,” Composites Research, Vol. 31, No. 4, 2018, pp. 171-176.
-

- 11. Kim, S.H., Lee, S., Ahn, D., and Park, J.Y., “PDMS Double Casting Method Enabled by Plasma Treatment and Alcohol Passivation,” Sensors and Actuators B: Chemical, Vol. 293, 2019, pp. 115-121.
-

 This Article
This Article
-
2019; 32(5): 211-215
Published on Oct 31, 2019
- 10.7234/composres.2019.32.5.211
- Received on Sep 17, 2019
- Revised on Sep 17, 2019
- Accepted on Oct 22, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Seung-Hwan Chang
-
School of Mechanical Engineering, Chung-Ang University
- E-mail: phigs4@cau.ac.kr






 Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.
Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.