- Thermal Decomposition Energy of Liquid Crystalline Epoxy
Seung Hyun Cho*†
Department of Materials Science and Engineering, Soong-sil University
- 열경화성 액정 에폭시 수지의 열분해 활성화에너지
조승현*†
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
A liquid crystalline thermosetting epoxy was synthesizes with DGE-DHMS and 1-Methyl Imidazole. To investigate thermal stability, activation energies for thermal decomposition were calculated via Flynn-Wall-Ozawa method and Kissinger method with the data obtained from TGA analysis. The result showed that there were no differences in thermal decomposition behavior between liquid crystalline phases and isotropic phase and also the same thermal decomposition mechanism was applied to the entire process.
합성한 Diglycidyl ether of 4,4’-dihydroxy-a-methylstilbene (DGE-DHMS)에 1-Methyl Imidazole을 2:1의 비율로 첨가하여 새로운 액정 에폭시 올리고머인 DDA를 합성하여 열안정성을 평가하였다. TGA분석을 통해 얻어진 결과로 볼 때 액정상과 isotropic상에서 열안정성의 차이는 관찰되지 않았고, Flynn-Wall-Ozawa method와 Kissinger method를 이용하여 계산한 열분해 활성화 에너지값의 비교 결과 열분해가 진행되는 동안 일정한 메커니즘이 작용함을 확인할 수 있었다.
Keywords: 열경화성액정에폭시(Liquid crystalline thermosetting epoxy), 열분해(Thermal degradation), 활성화에너지(Activation energy), TGA
1888년 액정 거동이 최초로 밝혀진 이래로 수많은 연구가 진행되어 왔지만 액정성 고분자(Liquid crystalline polymers, LCP)는 상대적으로 최근에 주목받게 되었다. LCP는 우수한 치수안정성, 낮은 열 팽창률, 우수한 고온 특성, 배향 방향에서의 우수한 기계적 특성 등 구조 재료 로서의 장점을 갖고 있으나 상대적으로 높은 비용, 가공을 위한 고온 요구 사항 및 약한 계면 전단 특성 등으로 인해 최근에는 열경화성 액정고분자(Liquid Crystalline Thermosets, LCT)에 관한 연구가 활발해지는 추세이다[1-4]. LCT는 열적, 화학적 또는 광화학적으로 가교가능한 말단기가 부착된 저분자 액정으로 정의되며, 우수한 기계적 특성, 화학물질에 대한 저항성, 경화시의 낮은 수축률과 전통적인 열경화성 고분자에 비해 높은 파괴 인성을 갖는다는 점 뿐만 아니라, 기계적, 전기적 및 자기장의 영향아래 분자의 배향을 변화시킬 수 있다는 장점을 가진다. 또한 가공 초기의 낮은 점도로 인해 복합재료 형성에도 유리하다[5,6].
LCT 중에서도 액정 에폭시(Liquid Crystalline Epoxies, LCE)는 액정과 에폭시 네트워크의 유용한 특성을 결합한 재료로서 에폭시의 잘 알려진 화학적 특성들과 다양한 성질을 부여할 수 있는 여러가지 관능기를 결합하여 열적, 기계적 및 자극 반응 특성을 보일 수 있으며, 복합재료의 매트릭스로 활용되는 경우 다양한 filler를 이용하여 센서, 액츄에이터, 스마트 코팅 및 접착제, 광학시스템, 소프트 로봇 등 다양한 분야에 적합한 기능성 재료 개발을 위한 새로운 재료로 활용될 수 있으므로 더욱 활발한 연구가 진행되는 추세이다. 특히, 전자패키징 용으로 응용되는 복합재료를 제조하는 경우 정밀하게 제어되는 전자부품의 발열현상에 의한 변형이 적어야 하고 우수한 열안정성이 요구되므로 열적 거동에 대한 연구가 매우 중요하다.
LCE 중에서도 Diglycidyl ether of 4,4’-dihydroxy-a-methylstilbene (DGE-DHMS)와 관련된 연구는 꾸준히 진행되어 오고 있는데 다양한 경화제를 이용하여 경화 kinetics와 최종 생성되는 LCE의 액정 구조를 조절할 수 있다. DGE-DHMS의 경화제로 사용되는 sulfanilamide(SAA)는 smectic 액정성 구조를 유발하는 것으로 잘 알려져 있는데 SAA의 amine기가 sulfonamide기 보다 반응성이 빠르므로 amine기에 의해 먼저 선형 고분자 구조가 생성되고 뒤 이은 sulfonamide의 반응에 의해 smectic 액정구조가 형성된다.
본 연구에서는 DGE-DHMS와 aniline의 반응으로 얻어진 새로운 열경화성 액정고분자인 DD-A의 합성과 열안정성을 파악하기 위해 TGA를 이용하여 초기열분해 활성화 에너지를 계산하였다.
2.1 합성
DGE-DHMS는 잘 알려진 방법과 동일한 방법으로 합성하였다[7]. Phenol (250 g), chloroacetone (111 mL), dichloromethane (150 mL)을 -10oC에서 교반시키고 70 mL의 황산을 2시간 동안 천천히 추가한 후 한시간 더 교반하였다. 얻어진 분홍색의 점도 있는 물질을 얼음물로 충분히 수세하여 잔여 촉매를 제거한 후 에탄올 및 증류수로 재결정을 반복하여 중성의 생성물을 얻어 여과 후 얻어진 4,4’-dihydroxy-α-methylstilbene (DHMS)를 70oC에서 8시간 이상 진공 건조한다.
DHMS (50 g), epichlorohydrin (173 mL), isopropanol (140 mL), 증류수 (17 mL)를 4구 플라스크에서 온도 70oC로 reflux시키며 20% NaOH 용액을 dropping funnel을 이용하여 천천히 첨가한다. 1시간 교반 후 두개의 층으로 분리되면 상층의 물은 제거하며 교반시킨다.
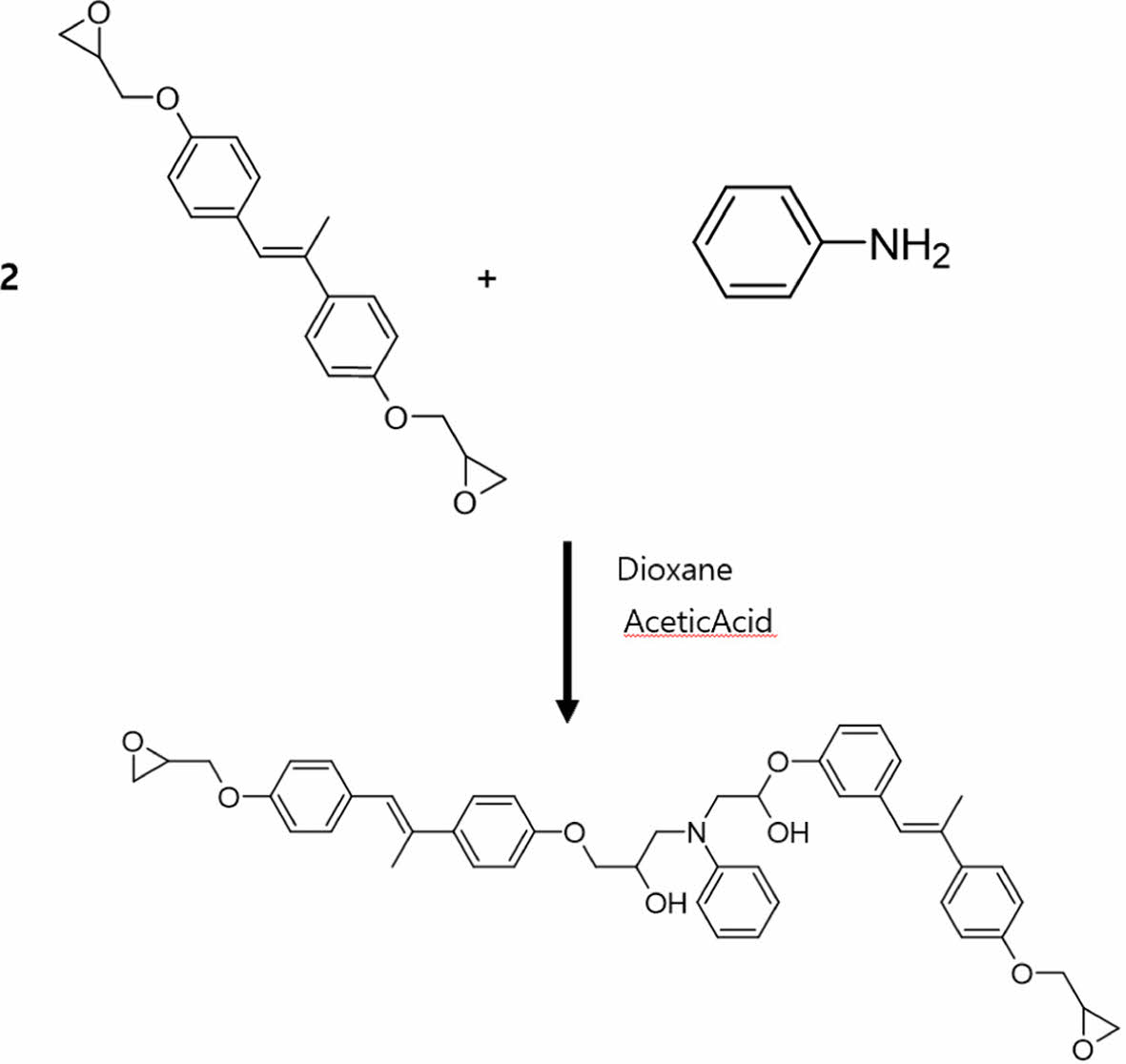
반응 종료 후 증류수에 침전시켜 얻어진 백색 파우더를 acetonitrile로 충분히 수세하여 잔여 epichlorohydrin을 제거하고 감압 여과 분리 후 50oC에서 8시간 이상 건조하여 DGE-DHMS를 얻는다. 1,4-Dioxane (20 mL)에 DGE-DHMS(10 g)을 가열 및 교반하여 용해시키고, 진공 증류로 정제한 Aniline (1.286 mL)을 한 방울씩 첨가한 후 acetic acid (10-15drops)를 가하고 120oC에서 2시간 30분간 reflux한 후 차가운 hexane에 부어 침전물을 생성시키고 12시간동안 냉장고에 보관한다. 여과하여 얻어진 침전물을 실온에서 진공 건조하여 생성물을 얻는다.
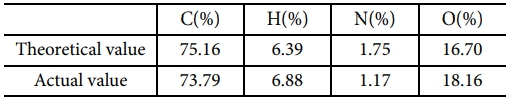
Table 1에 이론적인 원소분석 결과와 실험 결과를 비교하였다. Heat stage가 장착된 Cross-polarized optical microscope (POM)을 이용하여 10oC/min의 승온 속도로 400oC까지 가열하며 액정상의 전이 시간을 관찰하였고, DSC를 이용하여 상변화를 확인하였다.
2.2 경화
경화제로는 촉매성 경화제인 1-methyl Imidazole을 사용하였다. DDA를 담은 Qorpak® bottle을 가열하여 135oC에서 용융이 시작되면 110oC로 온도를 맞추고 1.0-3.0 wt%의 methyl Imidazole을 각각의 병에 첨가하여 격렬히 교반하여 aluminum boat에 부어 냉동보관하였다. 3.0 wt% 이상의 MI가 사용된 경우에는 경화 후 시료 색상이 붉게 변하였다. DDA각 상에서의 열적성질 분석을 위해 110oC에서 2시간 동안 2 wt%의 1-Methyl Imidazole로 경화한 LC-DDA, nematic 액정상태에서 경화된 DDA, 150oC에서 2시간 동안 2 wt%의 1-Methyl Imidazole로 경화하여 isotropic 상태에서 경화한 iso-DDA, 경화제를 첨가하지 않은 수지인 uncured-DDA를 각각 제조하였다.
2.3 에폭시당량(Epoxy Equivalent Weight, EEW)
일반적으로 에폭시 수지와 경화제를 혼합하여 경화반응을 진행시키는 경우 에폭시 수지의 당량에 해당하는 양의 경화제를 첨가해야 한다. 합성의 결과물로 생성된 에폭시는 이상적인 모노머의 구조보다는 올리고머로 형성될 가능성이 높기 때문에 EEW로 표현되는 에폭시 수지의 에폭시 함량을 계산하여 당량에 해당하는 경화제의 양을 첨가해야 최상의 물리적 특성을 얻을 수 있기 때문이다. EEW는 문헌의 방법으로 측정되었는데, 농축 염산 수용액 (26 mL)를 1 L의 Dimethylformamide에 첨가하여 충분히 섞어 hydrochlorination시약을 만든다. 2-4meq의 DD-A를 25 mL의 hydrochlorination 시약에 용해시키고 상온에서 20분간 놓아둔다. pH meter로 측정하며 과량의 산을 0.1N의 NaOH 용액으로 적정한다. DD-A를 첨가하지 않은 hydrochlorination 시약으로 동일한 방법을 이용하여 blank test를 2회 실시한다.
EEW는 다음의 식으로 계산된다.

단, A: DD-A 적정에 사용된 NaOH용액의 양(mL)
B: blank 적정에 사용된 NaOH용액의 양(mL)
C: DD-A의 질량(mg)
N: NaOH용액의 Normal농도
측정된 EEW의 값은 400~458의 범위에 있다.
2.4 열분해특성분석
TGA를 이용하여 합성된 시료의 열적 안정성을 분석하였다. 약 10 mg의 시료를 TGA pan에 넣고 질소 기류하에서 20-1000oC의 온도 범위에서 각각 3, 10, 15, 40oC/min의 승온 속도로 dynamic scan이 수행되는 동안의 질량 손실을 측정하여 열분해활성화에너지를 계산하였다. 열분해활성화에너지의 계산에는 최대분해속도에서의 값을 적용하는 Kissinger method와 해당 분해 %의 온도에 대한 값을 적용하는 Flynn-wall method를 이용하였다[8-11].
3.1 DD-A 액정성 확인
합성된 DD-A의 이상적인 구조는 Fig. 1과 같고 원소분석 결과는 Table 1에 나타내었다.
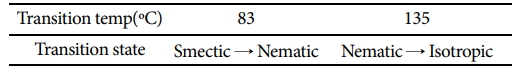
POM을 이용하여 상변화를 관찰 한 결과 Table 2에 나타낸 바와 같이 83oC에서 smectic상에서 nematic상으로의 변화가 관찰되었고 135oC에서 isotropic상으로 변화하였다. 30oC에서 150oC까지 10oC/min의 승온 속도로 DSC를 이용하여 전이 온도를 재확인하였다.
Fig. 2에 POM결과를 보였다.
3.2 열분해특성 분석
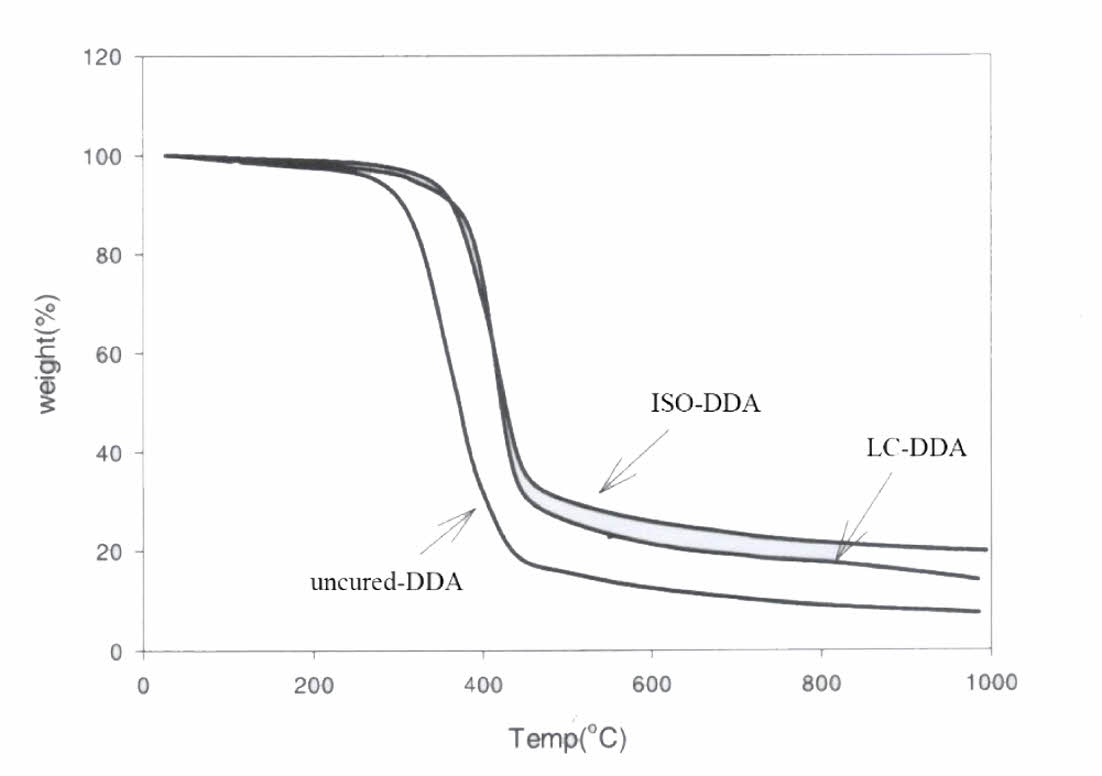
TGA를 이용하여 액정 물질들의 열분해 분석에 관한 연구들이 진행되어 왔으며, 크기가 큰 방향족 반복 단위를 함유한 액정 고분자는 열안정성이 높은 것으로 잘 알려져 있다. 예를 들어 Phenylethynyl 기능기를 함유한 방향족 LCT는 공기중에서 350oC까지 열에 의한 분해가 일어나지 않으며 질소 기류 하에서는 507oC에서 5%의 열분해 질량 손실이 있는 것으로 밝혀졌으며, 에폭시 수지가 지방족 사슬을 포함한 경화제로 경화된 경우 열 안정성은 감소한다[12,13]. DD-A의 각각 다른 상에서의 열안정성을 비교하기 위해 질소 기류 하에서 10oC/min의 가열 속도로 TGA 스캔을 수행하여 Fig. 3에 보였다.
LC-DDA는 110oC에서 2시간 동안 2 wt%의 1-Methyl Imidazole로 경화하여 nematic 액정상태에서 경화된 DDA, iso-DDA는 150oC에서 2시간 동안 2 wt%의 1-Methyl Imidazole로 경화하여 isotropic 상태에서 경화된 DDA, uncured-DDA는 경화제를 첨가하지 않은 수지를 나타낸다. 경화된 DDA는 경화되지 않은 DDA보다 열 안정성이 높고 상(phase)의 차이는 열 안정성에 영향을 미치지 않음을 확인할 수 있다.
이 결과는 가교 결합이 내열성을 향상시키기 때문인데, 더 많은 결합이 이루어질수록 더 많은 결합이 끊어져야 무게가 감소하거나 기계적 특성이 감소하기 때문이다. 액정상의 존재 유무가 열안정성과 무관하다는 사실은 semi-crystalline 폴리머와 amorphous 폴리머의 열 안정성의 경우와 유사하다. Penco et al.은 결정화도가 다른 amorphous 또는 semi-crystalline 형태의 다양한 멀티 블록 공중합체의 TGA 스캔 결과를 비교하였는데 열분해 결과는 결정화도 자체보다는 공중합체 각 성분의 특성에 의해 영향을 받음을 보였다[14]. 예를 들어 63.3%의 결정화도를 갖는 한 공중합체는 284oC에서 열분해가 시작되었고 19.5%의 결정화도를 갖는 다른 공중합체는 328oC에서 열분해가 시작되었는데, 이는 각기 다른 열분해 온도를 갖는 블록의 조성 차이로 인한 영향 때문이다.
이와 같은 실험 결과를 통해 열 안정성에 영향을 미치는 중요한 요인이 분자의 배향보다는 화학적 구조라는 것을 재확인할 수 있었다. 열분해 활성화에너지 계산에 이용되는 대표적인 준 실험적 방법 가운데 Flynn-Wall-Ozawa의 방법과 Kissinger의 방법을 이용하였는데 이 두 방법은 승온 속도를 달리하여 얻은 비등온 TGA 곡선으로부터 열분해 활성화에너지를 계산하는 방법이다. Flynn-wall method는 해당하는 분해 %의 온도에 대한 값을 적용하는 방법이고, Kissinger method는 최대 분해 속도일 때의 값을 적용하여 계산하는 방법으로 계산 방법에 차이가 있으므로 두 가지 계산법으로 활성화 에너지를 계산하여 정확도를 더 높이고자 하였다.
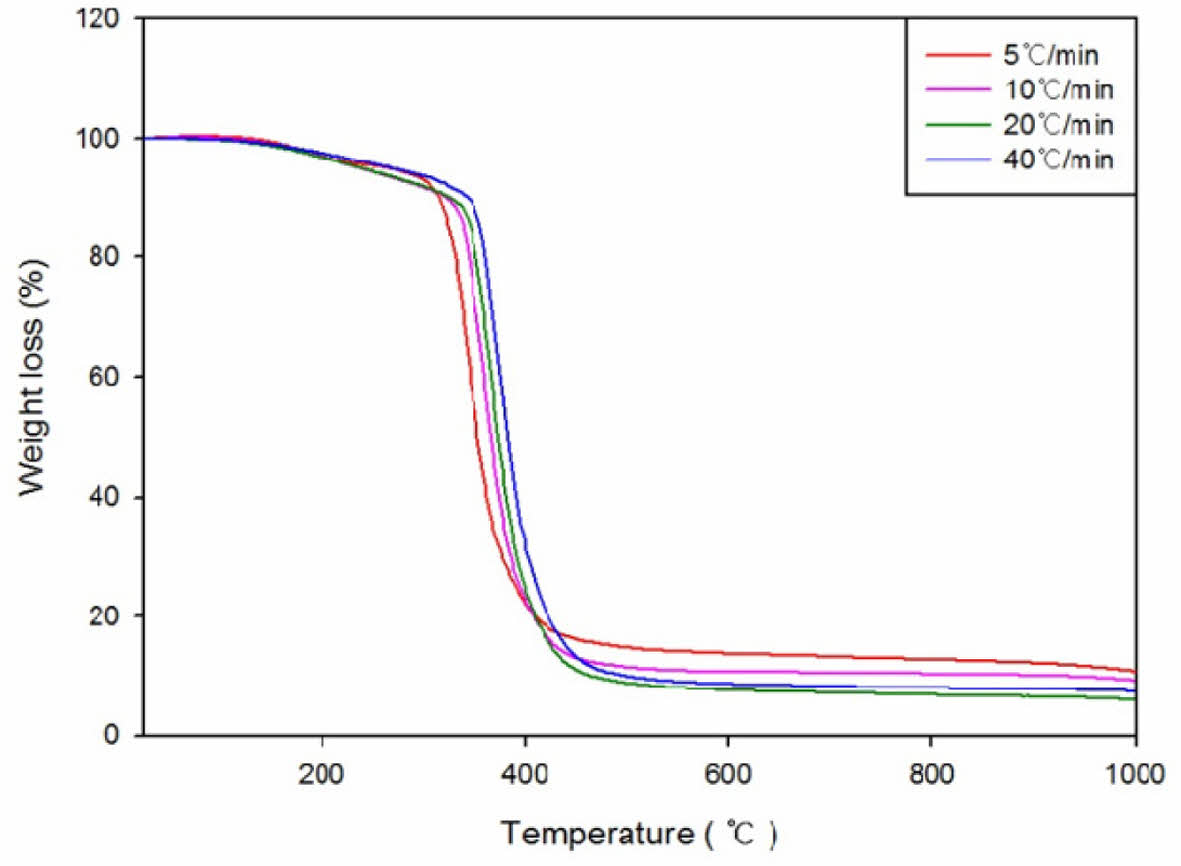
두 가지 방법의 계산을 위해 측정한 TGA곡선의 그래프를 Fig. 4에 나타내었다. TGA는 25oC에서 1000oC까지 5oC, 10oC, 20oC 및 40oC/min의 속도로 질소기류하에서 측정하였는데 승온속도가 증가할수록 분해에 소요되는 시간은 길어지므로 좀 더 높은 온도에서 분해가 이루어지고, 승온속도가 낮을수록 그 반대의 현상이 일어남을 알 수 있다.
특정 질량 손실에서의 열분해 활성화에너지 Ea는 온도 T, 승온 속도 q라 하면 dq/d(1/T)에 비례하므로 다음 식으로부터 구할 수 있다.

이 식에서 Ea는 전환율 α에서 측정된 질량손실에서의 활성화에너지, C는 상수이며 전환율

로 계산하였고, M0, Mt, Mf는 각각 초기질량, 시간 t에서의 질량, 최종 잔여질량을 의미한다.
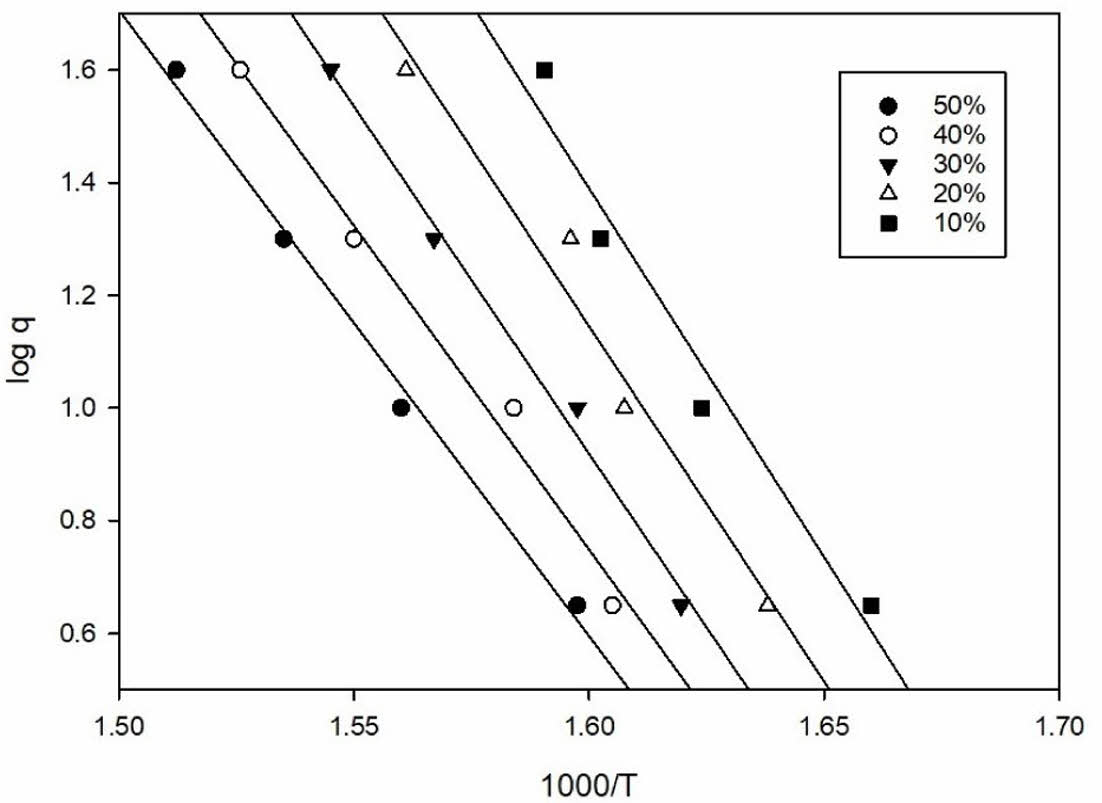
시료 당 승온 속도를 5, 10, 20 및 40oC/min으로 하여 측정하여, Flynn-Wall-Ozawa method에 의한 계산은
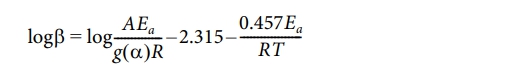
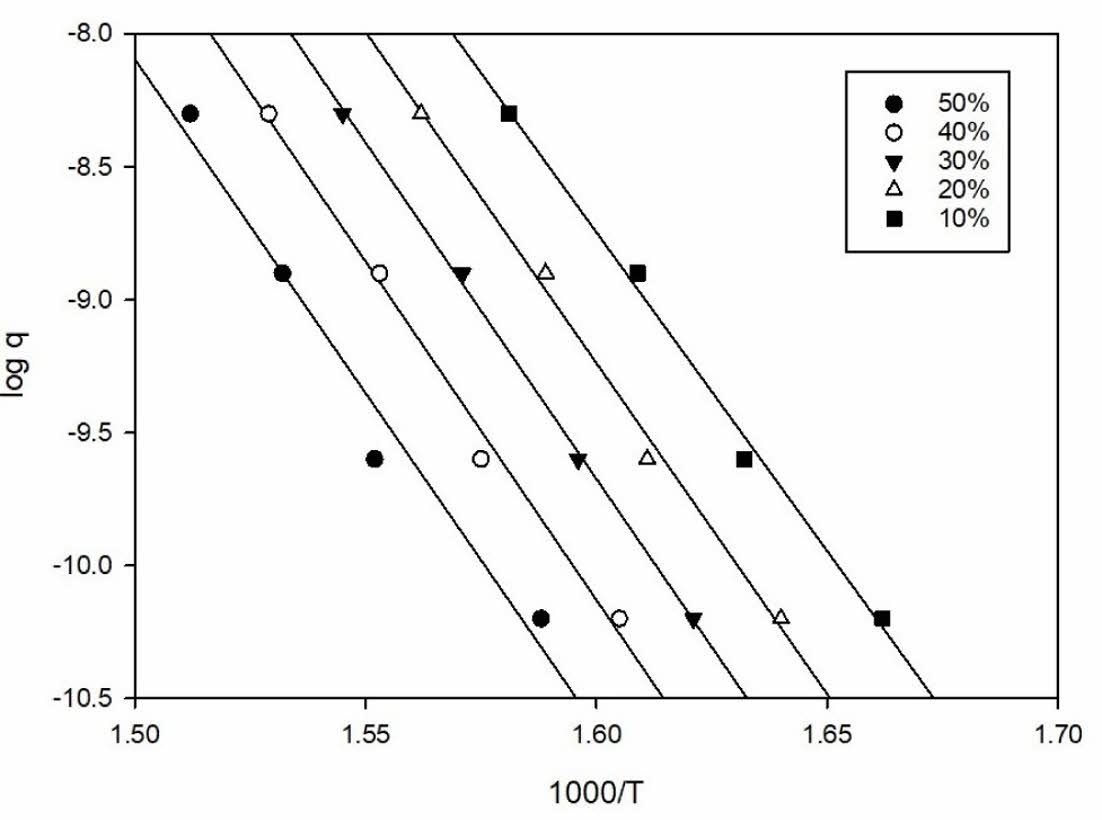
의 식을 이용하여 ln q vs 1000/T를 plot하여 그래프의 기울기를 이용하여 열분해활성화에너지를 계산하였고, Kissinger method에 의한 계산은

의 식을 사용하여 마찬가지로 plot한 후 그래프의 기울기를 통해 열분해활성화에너지를 계산하였다.
이를 바탕으로 Fig. 5와 Fig. 6에 Flynn-wall-ozawa와 Kissinger plot을 도시하였다.
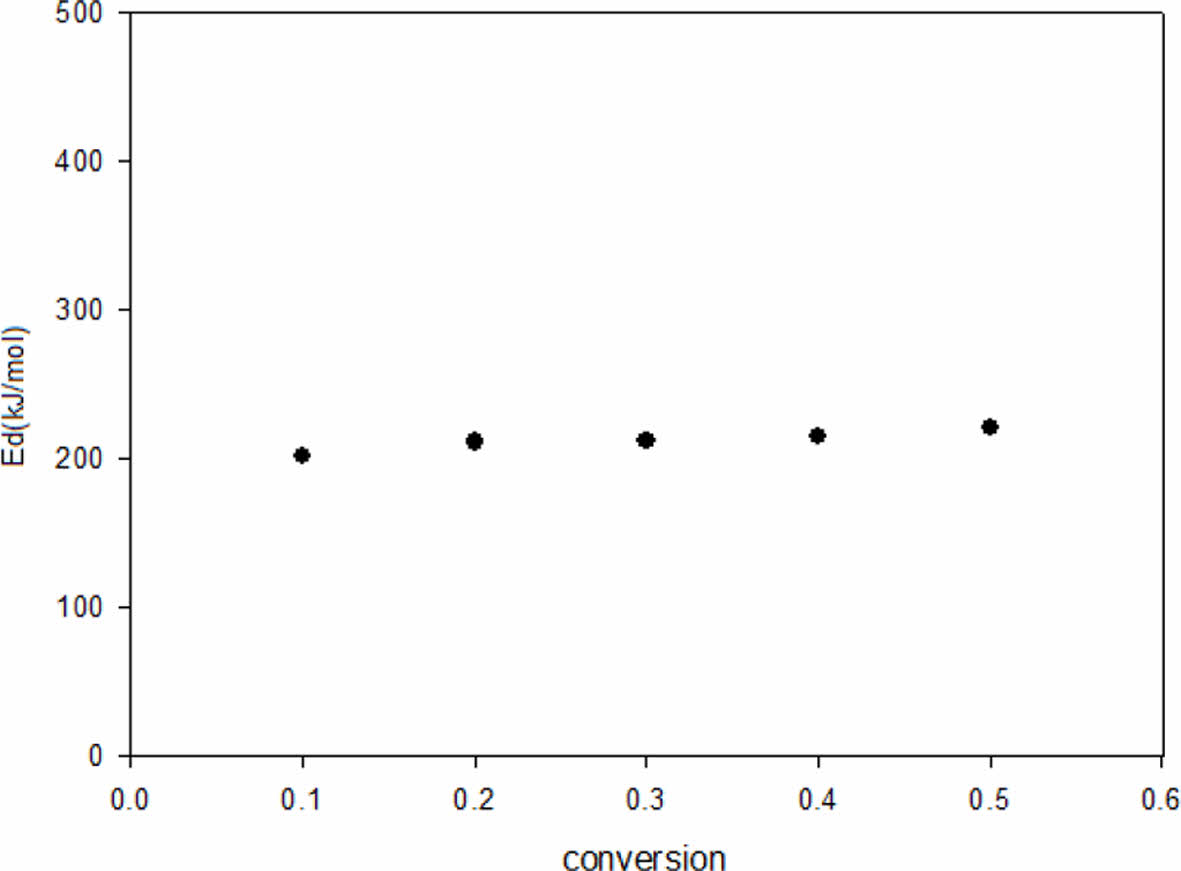
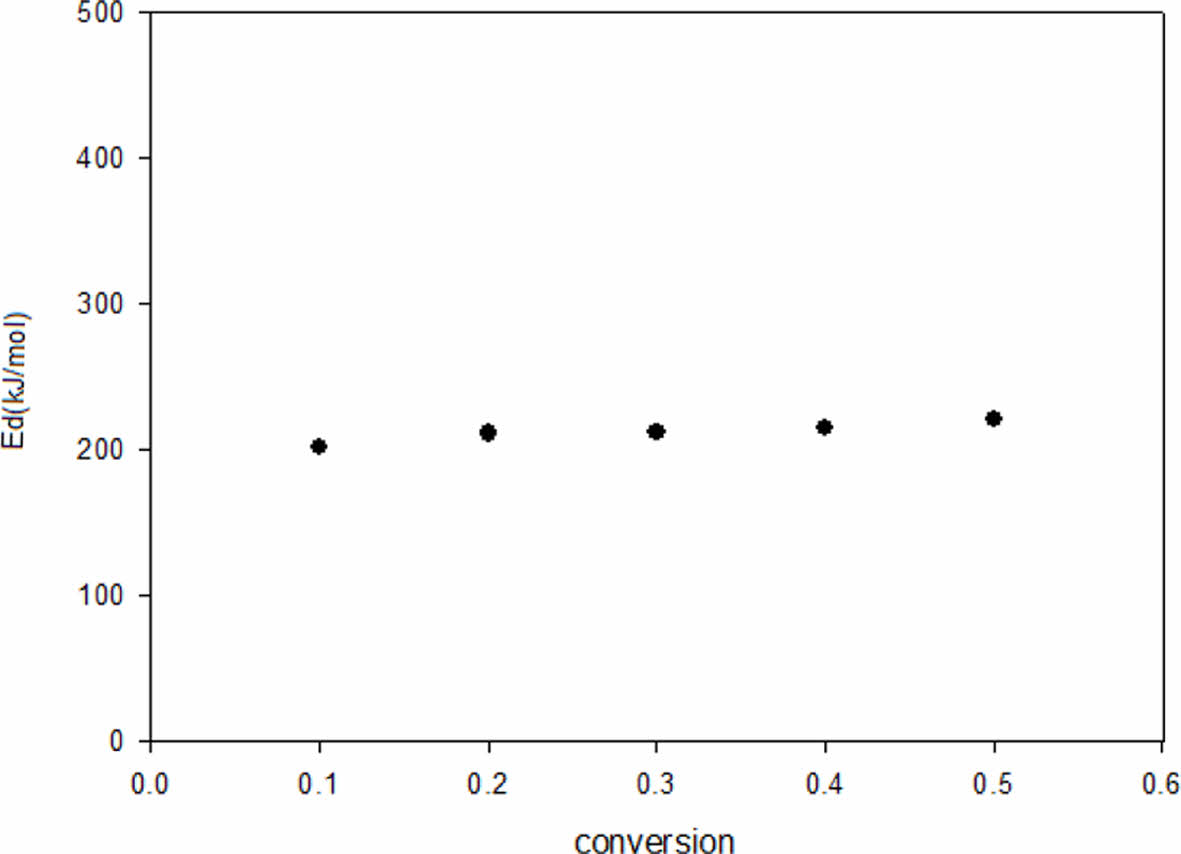
얻어진 Flynn-wall-ozawa 및 Kissinger plot을 이용하여 계산된 열분해 활성화 에너지를 Fig. 7과 Fig. 8에 각각 나타내었다.
그림에서 보여지는 바와 같이 TGA 시험을 통해 계산된 열분해 활설화에너지가 비교적 일정한 값으로 나타나는 것으로 볼 때 측정 범위에서 같은 열분해 메커니즘이 작용하고 있음을 알 수 있다.
Liaw 등에 의하면 acrylated diglycidyl ether of bisphenol-S의 열분해 활성화에너지는 152.67~378.19 kJ/mol, DGEBA의 경우 129.38~202.01 kJ/mol의 값을 갖는다. Lee 등은 DGEBA/4,4’-methylene diamine system에서 각각 다른 방법으로 측정한 활성화에너지 값을 182-222 kJ/mol이라고 보고하였으며, Lu 등은 methylene diamine으로 경화된 diglycidyl ether of bisphenol의 경우 101-202 kJ/mol로 4,4’-amino phenoxy hexane으로 경화했을 때의 47-89 kJ/mol보다 높은 값을 보인다고 보고하였다[15-17]. 이와 같이 DDA system의 열분해 활성화 에너지는 유사한 에폭시 들의 열분해 활성화 에너지와 비교했을 때 중상정도의 범위에 속함을 알 수 있다.
|
Fig. 1 Synthesis scheme for DD-A |

|
Fig. 2 (a) smectic phase at 40ºC, (b) Nematic phase at 110ºC, (c) Isotropic phase at 150ºC |
|
Fig. 3 TGA scan of DDA-MI system |
|
Fig. 4 TGA graph of DDA |
|
Fig. 5 Flynn-Wall-Ozawa plot |
|
Fig. 6 Kissinger plot |
|
Fig. 7 Activation energies for decomposition by Flynn-WallOzawa method |
|
Fig. 8 Activation energies for decomposition by Kissinger method |
본 연구에서는 열경화성 액정 에폭시인 DGE-DHAMS를 합성한 후 1-Methyl Imidazole을 당량비 2:1의 비율로 첨가하여 합성한 oligomer 형태의 새로운 액정 에폭시 DDA를 합성하고 이의 액정성을 확인한 후 TGA를 이용한 열분석을 통해 열분해 활성화 에너지를 계산하였다. 결과로서 열분해 활성화에너지가 비교적 일정한 것으로 보아 일정한 분해 메커니즘이 작용하고 있음을 확인하였고 계산된 열분해활성화에너지는 유사한 에폭시 수지들의 값과 비교했을 때 중상정도의 값을 보였다.
향후 연구를 통해 다양한 filler를 첨가하여 열적 성질의 평가 실험을 진행하면 복합재료의 matrix로서의 다양한 활용도를 기대할 수 있을 것으로 예상된다.
- 1. Lu, M., Shim, M., and Kim, S., “Thermal Degradation of LC Epoxy Thermosets”, Journal of Applied Polymer Science, Vol. 75, 2000, pp. 1514-1521.
-

- 2. Li, Y., Badrinarayanan, P., and Kessler, M., “Liquid Crystalline Resin Based on Biphenyl Mesogen: Thermal Characterization”, Polymer, Vol. 54, 2013, pp. 3017-3025.
-

- 3. Hirn, B., Carfagna, C., and Lanzetta, R., “Linear Precursors of Liquid Crystalline Thermosets”, Journal of Materials Chemistry, Vol. 6, 1996, pp. 1473-1478.
-

- 4. Lee, J., Shim, M., and Kim, S., “Synthesis of Liquid Crystalline Epoxy and Its Mechanical and Electrical Characteristics-Curing Reaction of LCE with Diamines by DSC Analysis”, Journal of Applied Polymer Science, Vol. 83, 2002, pp. 2419-2425.
-

- 5. Harada, M., Hamaura, N., Ochi, M., and Agari, Y., “Theraml Conductivity of Liquid Crystalline Epoxy/BN Filler Composites having Ordered Network Structure”, Composites: Part B, Vol. 55, 2013, pp. 306-313.
-

- 6. Akatsuka, M., and Takezawa, Y., “Study of High Thermal Conductive Epoxy Resins Containg Controlled High-order Structures”, Journal of Applied Polymer Science, Vol. 89, 2003, pp. 2464-2467.
-

- 7. Giamberini, M., Amendola, E., and Carfagna, C., “Liquid Cryastellne Epoxy Thermosets”, Molecular Crystals and Liquid Crystals, Vol. 89, 1995, pp. 9-22.
- 8. Moon, H., Kim, K., Hwangbo, S., and Cho, S., “Thermal Decomposition Activation Energy of Liquid Crystalline Epoxy Composite with Zirconia Filler”, Textile Science and Engineering, Vol. 52, 2015, pp. 206-214.
-

- 9. Flynn, J., and Wall, L., “A Quick, Direct Method for the Determination of Activation Energy from Thermogravimetric Data”, Journal of Polymer Science Part B: Polymer Letters, Vol. 4, 1966, pp. 323-328.
-

- 10. Yao, F., Wu, Q., Lei, Y., Guo, W., and Xu, Y., “Thermal Decomposition Kinetics of Natural Fibers: Activation Energy with Dynamic Thermogravimetric Analysis”, Polymer Degradation and Stability, Vol. 93, 2008, pp. 90-98.
-

- 11. Oh, J., Lee, J., and Ahn, W., “Non-isothermal TGA Analysis on Thermal Degradation Kinetics of Modified- NR Rubber Composites”, Polymer (Korea), Vol. 33, 2009, pp. 435-440.
- 12. Gavrin, A., Curts, C., and Douglas, E., “High-temperature Stability of a Novel Phenylethynyl Liquid-crystalline Thermoset,” Journal of Polymer Science Part A: Polymer Chemistry, Vol. 37, 1999, pp. 4184.
-

- 13. Frich, D., Economy, J., and Goranov, K., “Aromatic Copolyester Thermosets: High Temperature Adhesive Properties”, Polymer Engineering & Science, Vol. 37, 1997, pp. 541-548.
-

- 14. Penco, M., Sartore, L., Bignotti, F., D’Antone, S., and Landro, L., “Thermal Properties of a New Class of Block Copolymers Based on Segments of Poly(d,l-lactic-glycolic acid) and Poly(ε-caprolactone)”, European Polymer Journal, Vol. 36, 2000, pp. 901-908.
-

- 15. Liaw, D., and Shen, W., “Curing of Acrylated Epoxy Resin Based on Bisphenol-S”, Polymer Engineering & Science, Vol. 34, 1994, pp. 1297-1303.
-

- 16. Lee, J., Shim, M., and Kim, S., “Thermal Decomposition Kinetics of an Epoxy Resin with Rubber‐modified Curing Agent”, Journal of Applied Polymer Science, Vol. 81, 2001, pp. 479-485.
-

- 17. Lu, M., Shim, M., and Kim, S., “Thermal Degradation of LC Epoxy Thermosets”, Journal of Applied Polymer Science, Vol. 75, 2000, pp. 1514-1521.
-

 This Article
This Article
-
2024; 37(1): 1-6
Published on Feb 29, 2024
- 10.7234/composres.2024.37.1.001
- Received on Nov 12, 2023
- Revised on Dec 12, 2023
- Accepted on Jan 25, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Seung Hyun Cho
-
Department of Materials Science and Engineering, Soong-sil University
- E-mail: scho@ssu.ac.kr






 Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.
Copyright ⓒ The Korean Society for Composite Materials. All rights reserved.